2021年昨年とかわらず、暗い話題が続いていますが、認知症関連で明るい話題と言えば、エーザイ株式会社の認知症に対する画期的な新薬の話題です。エーザイ株式会社のホームページからプレスリリースを御紹介させて頂きます。
特に重要な点を太文字で示しておきます。
2020年12月10日 –バイオジェン(Nasdaq: BIIB、CEO:ミシェル・ヴォナッソス、以下 バイオジェン)とエーザイ株式会社(代表執行役CEO:内藤晴夫、以下 エーザイ)は、本日、バイオジェンがアルツハイマー病(AD)治療薬候補であるアデュカヌマブについて、厚生労働省に新薬承認(J-NDA)を申請したことをお知らせします。アデュカヌマブは、アミロイドベータ(Aβ)を標的とする抗体であり、臨床試験において、脳内のAβを除去し、ADによる軽度認知障害(MCI)および軽度ADの臨床状態の悪化を有意に遅らせることが示されています。
バイオジェンのCEOであるミシェル・ヴォナッソスは「日本は私たちにとってアデュカヌマブの申請を行った3番目の地域となります。日本での申請は全世界の患者様に本剤をお届けするという弊社のコミットメントを示すものです。日本は急速な高齢化という社会課題に直面しており、AD患者様やそのご家族、介護者の方々のケアや支援を改善する政策の立案と基盤構築において、世界でも先頭に立っています。承認されれば、アデュカヌマブは非常に深刻な疾患による影響に対処することができる可能性があり、日本の規制当局の審査に期待しています」と述べています。
エーザイのCEOである内藤晴夫は「日本は世界で最も高齢化が進んでおり、ADに関連する社会的負担は増々大きくなることが予想されています。当社は、30年以上にわたり、認知症の研究開発に取り組み、ADの当事者、ご家族とともにこの疾患と闘ってきました。今回の申請達成は、ADの病態の進行を遅らせ、できるだけ長く自立した生活を維持したいというAD当事者の想いに応え、高齢化社会における公衆衛生課題への取り組みに繋がる重要な第一歩となります」と述べています。
日本においては、本申請は標準審査の対象となります。アデュカヌマブは、この度の日本の申請に加え、現在、米国において優先審査による米国食品医薬品局(FDA)の審査が進行中であり、PDUFA(Prescription Drugs User Fee Act)アクション・デート(審査終了目標日)は2021年3月7日に設定されています。また、欧州医薬品庁においても審査中です。
このプレスリリースで重要なことは
①脳内のAβを除去し、ADによる軽度認知障害(MCI)および軽度ADの臨床状態の悪化を有意に遅らせることが示されています。
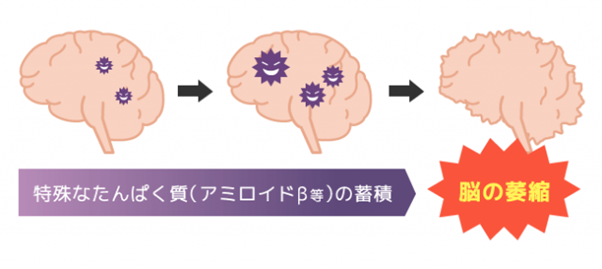
このイラストのように、アミロイドβ(Aβ)は、脳の萎縮というアルツハイマー型認知症の原因を引き起こすものですが、この物質を減らすという事は、今までの認知症の薬とは全く違うメカニズムであること、そして特に予防にも期待ができる事が特徴です。このブログでは、アミロイドβ除去がいかに重要かを何度もお話しして、その具体的な方法としてリコード法などの方法も説明して参りました。その考えに沿った新薬が登場することは、大変喜ばしい事です。
また、もう一つ重要なのは、
②日本においては、本申請は標準審査の対象となります。アデュカヌマブは、この度の日本の申請に加え、現在、米国において優先審査による米国食品医薬品局(FDA)の審査が進行中であり、PDUFA(Prescription Drugs User Fee Act)アクション・デート(審査終了目標日)は2021年3月7日に設定されています。また、欧州医薬品庁においても審査中です。
日本だけでなく、アメリカ、欧州にも申請しておりとくにアメリカでは2021/3/7に審査が終了する、つまり日本でもコロナワクチンのように迅速採用される可能性があるので、今年中には保険適応される可能性がある事です。
とはいえ、もう数カ月は処方できないので、次回から、リコード法によるアミロイドベータを減らす試みの食事、つまり認知症予防食として注目されているケトフレックス12/3についてお話しできればと思います。
今回も御一読いただき誠にありがとうございました。
文献1)2020年12月10日 エーザイ株式会社 プレスリリース
文献2)大熊 輝雄:現代臨床精神医学第12版 金原出版株式会社









